|
Фев
10
|
Нарушения моторики пищеварительного тракта при НАЖБПАвтор: Администратор | Рубрика: Общие новости, Статьи | Теги: моторика пищеварительного тракта, НАЖБП, урсодезоксихолев |
| Цель исследования: оценка некоторых показателей периферической электрогастроэнтерографии (ЭГЭГ) желудочно-кишечного тракта (ЖКТ) (суммарной мощности, мощности различных отделов ЖКТ и коэффициента ритмичности) у пациентов с неалкогольной жировой болезнью печени (НАЖБП) и определение влияния метаболической терапии основного заболевания препаратами урсодезоксихолевой кислоты (УХДК) на моторно-эвакуационную функцию ЖКТ. И.В. Лапинский, Е.Б. Авалуева, И.А. Оганезова, Е.В. Сказываева, А.В. Пушкина г. Санкт-Петербург Дизайн: проспективное обсервационное аналитическое (типа «случай — контроль») открытое рандомизированное исследование. Материалы и методы. Обследованы 124 человека: 49 больных с верифицированной НАЖБП (группа 1), 47 — с синдромом раздраженного кишечника (СРК) (группа 2), 18 — с НАЖБП и СРК (группа 3), 10 здоровых добровольцев (группа 4). У всех участников оценивали показатели периферической ЭГЭГ (показатели суммарной мощности и мощностей каждого из отделов пищеварительного тракта) и относительный коэффициент ритмичности. Тридцать пациентов группы 1 получали препараты УДХК в дозе 15 мг/кг массы тела в течение 3 месяцев с последующим повторным исследованием моторно-эвакуаторной функции ЖКТ. Результаты. Нами введен коэффициент нарастания мощности ЖКТ в постпрандиальном периоде — coefficient of postprandial growth (kPG). У пациентов группы 1 отсутствовал прирост суммарной мощности (kPGP(s) = 0,58). У участников групп 2, 3 и 4 kPGP(s) был выше 1,0 и составил 1,54, 2,11 и 1,66 соответственно (р < 0,05 для отличия группы 1 от каждой из других групп). При оценке kPGP(i) в различных отделах ЖКТ у пациентов группы 1 отмечен неадекватный ответ на стандартную пищевую нагрузку в виде снижения мощности во всех отделах, кроме двенадцатиперстной кишки. Наименьшее нарастание мощности в постпрандиальном периоде наблюдалось у пациентов группы 1 в толстой кишке: kPGP(i) — 0,52, 1,34, 2,01, 1,25 в группах 1, 2, 3 и 4 соответственно. После лечения у 30 больных группы 1 отмечена тенденция к увеличению прироста суммарной мощности в постпрандиальном периоде: до лечения — 1,27 (0,47; 2,89), после лечения — 2,74 (1,67; 4,57), а также тенденция к росту мощности во всех отделах ЖКТ. Заключение. Изменение ритма работы кишечника после пищевой нагрузки у пациентов с НАЖБП (группа 1) более значительно, чем у участников других групп. На фоне терапии препаратами УДХК отмечена гармонизация моторно-эвакуационной функции ЖКТ. Результаты исследования открывают перспективы для понимания патогенеза НАЖБП и моторно-эвакуаторных нарушений работы пищеварительного тракта при данном заболевании. Ключевые слова: неалкогольная жировая болезнь печени, моторно-эвакуационная функция желудочно-кишечного тракта, синдром раздраженного кишечника, метаболический синдром, урсодезоксихолевая кислота. Авторы заявляют об отсутствии возможных конфликтов интересов. Для цитирования: Лапинский И.В., Авалуева Е.Б., Оганезова И.А., Сказываева Е.В., Пушкина А.В. Нарушения моторики пищеварительного тракта при неалкогольной жировой болезни печени // Доктор.Ру. 2019. № 3 (158). С. 15–20. DOI: 10.31550/1727-2378-2019-158-3-15-20 Неалкогольная жировая болезнь печени (НАЖБП) на протяжении последних десятилетий занимает лидирующие позиции по распространенности среди диффузных заболеваний печени [1]. Чаще всего НАЖБП носит доброкачественный характер, однако с жировой дистрофией печени ассоциированы воспалительные процессы в гепатоцитах с развитием неалкогольного стеатогепатита (20–30%) и в последующем фиброза печени [2]. Обычно клинически бессимптомная НАЖБП представляет собой фенотипически полиморфное заболевание, которое по своей системной природе имеет переменные клинические проявления и широкий спектр лабораторных признаков. Понимание фенотипического полиморфизма НАЖБП является ключевым в диагностическом процессе, так как в повседневной клинической практике большинство пациентов, у которых в последующем выявляется НАЖБП, часто обращаются за медицинской помощью либо в связи с появлением симптомов желудочной или кишечной диспепсии, либо из-за других необъяснимых для них нарушений работы гастроинтестинального тракта или его моторики, которые, по данным УЗИ печени, ассоциируются с жировым гепатозом [3–5]. В последнее время активно изучаются состояние и значимость органов пищеварения в развитии НАЖБП. Особенно интересными представляются изменения моторики пищеварительного тракта у больных с избыточным питанием [6]. Известно, что моторика, опорожнение желудка и тонкой кишки играют важную роль в регуляции растяжения желудка и интестинальной экспозиции нутриентов, а соответственно, в контроле ощущений насыщения и пресыщения [7]. В одном из исследований показано, что у мышей, накормленных пищей с высоким содержанием жира, наблюдается снижение холецистокинин- и олеатиндуцированного ингибирования желудочной моторики [8]. В нескольких исследованиях получены данные о замедленном опорожнении желудка в постпрандиальном периоде у лиц с ожирением [9–11]. Моторика тонкой кишки также влияет на абсорбцию нутриентов, и это может играть определенную роль в развитии ожирения. Исследование N.P. Hyland и соавт. подтвердило наличие нарушений интестинальной моторики, модификацию функции подслизистых нервных окончаний и снижение электрогенного транспорта глюкозы у мышей с ожирением [12]. Несмотря на то что ожирение — один из наиболее важных этиологических факторов развития метаболического синдрома и НАЖБП, лишь небольшое количество исследований посвящены нарушению интестинальной моторной функции при данной патологии. В подобных работах установлено, что при НАЖБП и циррозе печени неалкогольной этиологии имеют место пролонгирование ороцекального транзита и увеличение суммарной мощности ЖКТ [13, 14]. Это свидетельствует об изменениях моторики пищеварительного тракта при НАЖБП и метаболическом синдроме и вероятных нарушениях интестинального барьера, в то время как системное воспаление и нейрональная сигнализация, по-видимому, являются ключевыми факторами, поддерживающими данные нарушения. Ожирение и накопление жира в печени предположительно связаны с возникновением или развитием моторно-эвакуационных нарушений органов пищеварения. Существует много ассоциированных с НАЖБП явлений, таких как дисгармонизация кишечной микробиоты, нарушение кишечного барьера, моторики кишечника и дисфункция со стороны нервной системы, которые играют существенную роль в возникновении заболевания и связаны с иммунной активацией и воспалением. В работе Я.М. Вахрушева и М.В. Ляпиной [15] при исследовании электрической активности отделов ЖКТ методом периферической электрогастроэнтерографии (ЭГЭГ) у пациентов с метаболическим синдромом установлена недостаточная реакция моторики желудка в ответ на пищевую стимуляцию. В этой работе авторы также показали, что характерные для метаболического синдрома отклонения в гормональном статусе коррелируют с выявленными нарушениями моторики ЖКТ — снижением скорости эвакуации из двенадцатиперстной кишки и уменьшением электрической активности тонкой кишки. Исследования по так называемой оси «печень — кишка» свидетельствуют о роли микробиоты кишечника, избыточного бактериального роста и дисфункции кишечной проницаемости в патогенезе НАЖБП [16]. В работах P. Brun и соавт. показано, что печеночные клетки чувствительны к бактериальным эндотоксинам, а у генетически тучных мышей наблюдается нарушение кишечной проницаемости, приводящее к увеличению портальной эндотоксемии [17]. Изучение моторно-эвакуаторной функции пищеварительного тракта посредством определения миоэлектрической активности (МЭА) начато более 40 лет назад. В 1963 г. А.М. Bilgutay и соавт. использовали электрическую стимуляцию — интралюминальные электроды, введенные через назогастральный зонд после лапаротомии, для стимуляции и укорочения периода восстановления функции подвздошной кишки при парезах в постоперационном периоде [18, 19]. В настоящее время существуют неинвазивные методы исследования МЭА желудка с помощью накожных электродов, например ЭГЭГ [20]. С учетом вышесказанного изучение моторной функции пищеварительного тракта у пациентов с НАЖБП и ее возможная модификация посредством определенных лекарственных воздействий представляют научный и клинический интерес. Цель нашего исследования: оценка некоторых показателей периферической ЭГЭГ ЖКТ (суммарной мощности, мощности различных отделов ЖКТ и коэффициента ритмичности) у пациентов с НАЖБП и определение влияния метаболической терапии основного заболевания препаратами урсодезоксихолевой кислоты (УХДК) на моторно-эвакуационную функцию ЖКТ. Материалы и методы В проспективное обсервационное аналитическое (типа «случай — контроль») открытое рандомизированное исследование путем сплошной выборки отобраны 124 человека. Обследование проводилось с 2014 по 2017 г. амбулаторно и в условиях стационара на базе клиники кафедры пропедевтики внутренних болезней, гастроэнтерологии и диетологии имени С.М. Рысса ФГБОУ ВО «Северо-Западный государственный медицинский университет имени И.И. Мечникова» Минздрава России. Участники были разделены на 4 группы. При включении в исследование проводили стандартное клиническое обследование, периферическую ЭГЭГ. Характеристика групп представлена в таблице 1. Таблица 1. Характеристика участников исследования
В исследование не включали лиц моложе 18 лет и пациентов с тяжелой коморбидной патологией, с острыми гепатитами любой этиологии, хроническими заболеваниями печени иной этиологии, чем НАЖБП (вирусными, алкогольными, аутоиммунными гепатитами и проч.). Диагноз НАЖБП был установлен на основании результатов комплексного обследования в соответствии с существующими международными и российскими стандартами [21]. Диагноз синдрома раздраженного кишечника (СРК) ставили в соответствии с Римскими критериями III пересмотра, которые были актуальны на момент формирования групп [22]. Электрическую активность ЖКТ оценивали с помощью периферической ЭГЭГ. Она проводилась с использованием электроэнтерографа ГЭМ-01-«Гастроскан-ГЭМ» (ЗАО НПП «Исток-Система»). Данный прибор позволяет определить электрическую активность и моторно-эвакуаторную функцию желудка, двенадцатиперстной, тощей, подвздошной и толстой кишки. В настоящем исследовании использован стандартный вариант периферической ЭГЭГ: 45-минутная съемка тощаковой фазы и 45-минутная съемка постпрандиальной фазы. Стандартный завтрак для исследования в постпрандиальном периоде включал в себя черный чай с 5 г сахара, 100 г гречневой каши и 30 г белого хлеба. Оценивали показатели суммарной мощности P(s), мощностей каждого из отделов пищеварительного тракта P(i) и относительный коэффициент ритмичности: Kritmотн% = Kritmнатощак/Kritmпостпр. × 100% После включения в исследование и выполнения первичной периферической ЭГЭГ 30 пациентов из группы 1 получали метаболическую терапию препаратом УДХК в дозе 15 мг на 1 кг массы тела в течение 3 месяцев с последующим повторным определением моторно-эвакуаторной функции ЖКТ. Регистрацию клинических показателей и периферическую ЭГЭГ у них производили в 1-й и 90-й дни исследования. Все участники подписали информированное согласие, а также согласие на обработку персональных данных. Исследование одобрено локальным этическим комитетом ФГБОУ ВО «СЗГМУ им. И.И. Мечникова» Минздрава России. Для статистической обработки полученных данных использована программа SPSS 17.0 (SPSS Inc., США). Вследствие выраженных отличий распределения вариационных рядов от нормального, выявленных тестами Колмогорова — Смирнова и Фишера, для описательной статистики выбраны медиана и квартили, а для анализа данных — непараметрические статистические критерии. Сравнение групп по номинальным показателям проводилось с помощью критерия χ2, по количественным показателям — с помощью критерия Манна — Уитни. Различия считали статистически значимыми при р < 0,05. Результаты Миоэлектрическая активность желудочно-кишечного тракта Показатели МЭА ЖКТ в исследованных группах представлены в таблице 2. Таблица 2. Показатели миоэлектрической активности желудочно-кишечного тракта (ЖКТ), Ме (Q1; Q3)
Значения, полученные при измерении показателей, были статистически неоднородными и разнонаправленными при сравнении медианы показателей мощностей как в тощаковой фазе, так и в постпрандиальном периоде (коэффициент вариации составил более 33%). С учетом этого факта и того, что важным в оценке функции отделов пищеварительного тракта стало изменение именно суммарной мощности ЖКТ и мощности каждого из его отделов, нами был разработан и введен показатель нарастания мощности в ЖКТ — коэффициент нарастания мощности в постпрандиальном периоде — coefficient of postprandial growth (kPG). Он рассчитывался как частное показателя электрической активности после стандартной пищевой стимуляции и показателя электрической активности тощаковой фазы (kPG = Pпосле еды/Рнатощак). Если kPG был больше 1,0, у пациента в постпрандиальном периоде имело место нарастание мощности, меньше 1,0 — снижение мощности. kPGP(s) свидетельствовал об изменении суммарной мощности, kPGP(i) — об изменении мощности отделов ЖКТ. Анализ kPGP(s) показал, что у пациентов группы 1 в постпрандиальном периоде отсутствовал прирост суммарной мощности: kPGP(s) у них — 0,58 (0,27; 2,14). У участников групп 2, 3 и 4 kPGP(s) был выше 1,0 и составил 1,54 (1,0; 3,04), 2,11 (1,20; 14,27) и 1,66 (1,59; 1,92) соответственно (р < 0,05 для отличия группы 1 от каждой из других групп). У больных группы 3 выявлено более значительное повышение суммарной мощности по сравнению с участниками других групп. При оценке kPGP(i) в различных отделах ЖКТ у пациентов группы 1 в постпрандиальном периоде отмечался неадекватный ответ на стандартную пищевую нагрузку в виде снижения мощности во всех отделах, кроме двенадцатиперстной кишки; у участников групп 2, 3 и 4 ответ на пищевую стимуляцию во всех отделах ЖКТ был нарастающим — kPGP(i) у них во всех отделах превышал 1,0 (табл. 3). При сравнении kPGP(i) в двенадцатиперстной кишке выявлено, что в группе 1 этот показатель был значимо ниже, чем в группах 3 и 4 (в обоих случаях р < 0,05) (см. табл. 3). Таблица 3. Коэффициент прироста мощности kPGP(i) различных отделов желудочно-кишечного тракта (ЖКТ), Ме (Q1; Q3)
Наименьшее нарастание мощности в постпрандиальном периоде отмечено у пациентов группы 1 в толстой кишке: kPGP(i) у них был самым низким, прирост мощности в данном отделе ЖКТ составил 0,52. У больных группы 2 (СРК) и группы 3 (сочетание НАЖБП и СРК) ответ на пищевую нагрузку в толстой кишке по сравнению с показателем группы 4 имел тенденцию к гиперкинетической активности (р2–4 > 0,05) или превышал показатель у здоровых лиц (р3–4 < 0,01) (см. табл. 3). Показатели нарастания Kritmотн% в постпрандиальном периоде представлены в таблице 4. У пациентов группы 1 во всех отделах пищеварительного тракта он был снижен, в то время как в других группах после приема пищи ритмичность отделов ЖКТ возрастала. Kritmотн% в тощей кишке у пациентов групп 1, 2 и 3 не достигал уровня группы 4 (здоровые добровольцы). В группе 3 отмечено нарастание Kritmотн%, но в тощей кишке оно было значимо ниже, чем в группе 4, а в толстой кишке Kritmотн% превышал таковой в группе 4. Таблица 4. Нарастание коэффициента ритмичности (Kritmотн%) отделов желудочно-кишечного тракта (ЖКТ) у пациентов в постпрандиальном периоде, %
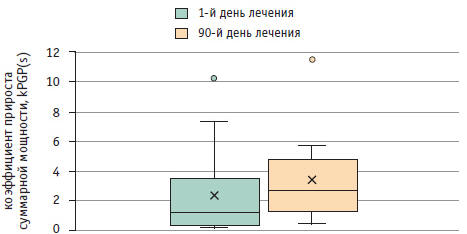
Результаты исследования периферической электрогастроэнтерограммы пациентов с неалкогольной жировой болезнью печени после терапии урсодезоксихолиевой кислотой Тридцать больных с НАЖБП (из группы 1) в течение 3 месяцев получали препараты УДХК в дозе 15 мг/кг массы тела. После лечения у них отмечена тенденция к увеличению прироста суммарной мощности в постпрандиальном периоде: до лечения — 1,27 (0,47; 2,89), после лечения — 2,74 (1,67; 4,57) (рис.), а также тенденция к увеличению мощности во всех отделах ЖКТ (табл. 5).
Рис. Показатель нарастания суммарной мощности всех отделов гастроинтестинального тракта после пищевой стимуляции на фоне терапии Таблица 5. Коэффициент прироста мощности kPGP(i) различных отделов желудочно-кишечного тракта (ЖКТ) у пациентов с неалкогольной жировой болезнью печени до и после терапии, Ме (Q1; Q3) (n = 30)
У пациентов, получавших препарат УДХК, при сравнении показателей Kritmотн% в динамике выявлена некоторая гармонизация работы всех отделов ЖКТ в ответ на пищевую стимуляцию, но статистически значимых изменений не было. Обсуждение В нашем исследовании получены данные о неадекватной электрической активности пищеварительного тракта у пациентов с НАЖБП в ответ на пищевую стимуляцию. Мы продемонстрировали, что у больных с НАЖБП в постпрандиальном периоде отмечается значительное снижение прироста суммарной мощности и прироста мощности каждого из отделов ЖКТ в номинальных значениях и при сравнении с другими исследуемыми группами. Изменение ритма работы кишечника после пищевой нагрузки у пациентов с НАЖБП также было более значительным: в отличие от больных с СРК и здоровых добровольцев у них наблюдалось уменьшение ритмичности ЖКТ в ответ на пищевую нагрузку, при этом наибольшие изменения и мощности, и ритмичности зарегистрированы в толстой кишке. Нам представляется интересным, что у пациентов, а не у здоровых добровольцев была снижена ритмичность тощей кишки после пищевой нагрузки. Требует дальнейшего анализа и изучения электрическая активность ЖКТ у пациентов с НАЖБП, страдающих СРК, необходимы исследования большего числа больных с подобной патологией, так как, несмотря на однонаправленность изменений суммарной мощности и мощности, например, тощей кишки в постпрандиальном периоде, многие данные требуют дальнейшего осмысления. Показанные изменения моторно-эвакуационных нарушений в ЖКТ при НАЖБП могут свидетельствовать о более значимом вовлечении пищеварительного тракта в патогенез жировой дегенерации печени и улучшить понимание роли нарушений эвакуаторной функции ЖКТ и дисфункции кишечной проницаемости при данной патологии. Мы полагаем, что дискоординация работы ЖКТ, в частности возможное уменьшение скорости эвакуации пищевого химуса по тонкой кишке, низкий тонус и снижение ритмичности толстой кишки у больных НАЖБП после пищевой нагрузки, нарушает соотношение питательных веществ в составе кишечного потока, тем самым изменяя темп их переноса из энтеральной во внутреннюю среду, нарушая гомеостаз и усугубляя метаболические нарушения, в том числе в обмене липидов. В ходе нашего исследования у пациентов с НАЖБП установлена гармонизация моторно-эвакуационной функции ЖКТ на фоне терапии препаратами УДХК в течение 3 месяцев, что может являться темой дальнейших исследований — не только эффективности данного средства для улучшения метаболизма гепатоцитов, но и определения перспективы влияния на моторику ЖКТ, в первую очередь отделов тонкой кишки. Заключение Проведенное исследование является перспективным для понимания моторно-эвакуаторных нарушений в пищеварительном тракте и патогенеза неалкогольной жировой болезни печени (НАЖБП). Данные, полученные в результате работы, могут дополнить существующую концепцию патогенеза НАЖБП и способствовать оптимизации терапии этой патологии. Литература / References
Статья опубликована на сайте http://www.gastroscan.ru |