|
Фев
25
|
| Алкогольная болезнь печени (АБП) — это различные морфологические формы поражения печени, возникающие при употреблении гепатотоксичных доз алкоголя и обусловленные этим клинические проявления. Выделяют три основных формы АБП — жировая дистрофия, алкогольный гепатит и цирроз печени. О распространенности АБП можно судить по статистическим данным, которые отражают размер среднедушевого ежегодного употребления алкоголя и масштаб медицинских последствий. Эксперты полагают, что в России 13,5 млн человек больны алкоголизмом, алкогольными психозами и другими тяжелыми болезнями, вызванными последствиями алкогольной интоксикации. Употребляет алкоголь в опасных для здоровья дозах 1/3 мужчин трудоспособного возраста [1]. Известно, что в России высокий уровень среднедушевого потребления алкоголя сочетается с положительной алкогольной установкой, традициями, «северным типом употребления» (крепкие напитки, большие дозы), низким качеством алкоголя. Алкоголизация населения в РФ — тяжелая социальная и медицинская проблема [2, 3]. Так, среди госпитализированных в возрасте 20–59 лет хроническая алкогольная интоксикация (ХАИ) выявлена в 27,0–46,6% [2, 4]. Среди пациентов, госпитализированных по поводу патологии печени и заболевания желудочно-кишечного тракта, количество лиц с ХАИ значительно выше. Как видно из табл., прослежена прямая зависимость характера поражения печени от дозы ежедневно употребляемого алкоголя [5]. Следует отметить, что тип напитка значения не имеет, важным является количество спирта [5, 6].
Проблема патологии печени, вызванной алкоголем, является актуальной и для Европы, и для Северной Америки. Этой проблеме было уделено значительное внимание на 47 ежегодном конгрессе Европейской ассоциации по изучению печени (European Association for the study of the liver, EASL) (Барселона, апрель 2012 г.). В рамках конгресса двухдневная программа последипломного образования была посвящена алкогольной болезни печени [14]. Было отмечено, что алкоголь является главной причиной печеночной патологии в Европе, при этом был констатирован преобладающий рост заболеваний печени алкогольного генеза в Восточной Европе, хотя подобная динамика наблюдается и в таких странах, как Великобритания, Ирландия и Финляндия. Прослежена четкая и прямая корреляция количества потребленного этанола и смертности от болезней печени в каждой стране Европейского Союза. Обращено также внимание на связь типа потребления и характер поражения печени. Весьма негативную оценку получил такой тип употребления, как «кутежное» (too much too fast), т. е. 5 и более доз для мужчин за 2 часа [7]. В России ежегодно от АБП умирают около 14 тыс. человек, а вклад алкоголизма в общую смертность составляет от 11,9 до 23,4% [1]. АБП отличает высокая распространенность и зависимость от количества употребленного алкоголя, типа пьянства и длительности алкоголизации [8]. При АБП самым частым проявлением поражения печени является жировая дистрофия печени (ЖДП) — патология, вызванная нарушением метаболизма липидов в гепатоците, приводящим к накоплению жира в печени. При этом количество жира, главным образом триглицеридов, составляет более 5% сухого вещества органа [9, 10]. ЖДП определяют также как стеатоз печени, гепатостеатоз, жировой гепатоз, жирная печень (fat liver). Гистологическое исследование позволяет диагностировать ЖДП при выявлении гепатоцитов, в цитоплазме которых имеются жировые включения — крупнокапельные или мелкокапельные. При крупнокапельной ЖДП размер жировых вакуолей превышает или соответствует диаметру ядра клетки. Как правило, такие гепатоциты расположены в третьей и второй зоне [1, 9]. ЖДП по степени жировой инфильтрации подразделяют на незначительную, умеренную и выраженную. Более точная градация: 1+ — менее 25% гепатоцитов содержат жир, 2+ — 25–50% гепатоцитов содержат жир, 3+ — 50–75% и 4+ — 75% и более гепатоцитов. При мелкокапельном стеатозе в гепатоците выявляют большое количество мелких жировых капель, ядро остается в центре. Считается, что накопление микровезикул связано с большим поражением митохондрий и более активным синтезом липидов [9]. При стеатозе печени часто отмечается анизокариоз, когда ядра гепатоцитов в перицентральной зоне имеют разную форму и размеры. Синусы обычно расширены, и в их просвете встречаются нейтрофилы. Подчеркивается, что ЖДП не сопровождается воспалительной инфильтрацией портальных трактов [1, 11]. Изначально ЖДП была выявлена и тщательно изучена у лиц, длительно и регулярно употреблявших алкоголь в гепатотоксичных дозах. Определены механизмы накопления липидов в гепатоцитах, показано, что эти механизмы тесно связаны и обусловлены метаболизмом алкоголя в организме. Перорально поступивший алкоголь окисляется до ацетальдегида при участии фермента алкогольдегидрогеназы (АДГ), 10–15% алкоголя окисляется в слизистой желудка, 80–85% — в печени, 5% выделяется с мочой в неизмененном виде. Ацетальдегид, образовавшийся в цитозоле, весьма токсичен. Его патогенный эффект зависит от количества образовавшегося ацетальдегида, что обусловлено в первую очередь объемом поступившего алкоголя и скоростью его окисления. Темп окисления этанола прямо связан с активностью имеющихся у индивидуума изоферментов АДГ. Количество находящегося в печени ацетальдегида зависит как от темпа его образования, так и от скорости дальнейшего метаболизма. Ацетальдегид при участии альдегиддегидрогеназы (АлдДГ) трансформируется в ацетил-КоА, далее либо в ацетат, с последующим метаболизмом до углекислого газа и воды, либо, включаясь в цикл лимонной кислоты, трансформируется в другие соединения, в том числе и жирные кислоты. Эффективность АлдДГ во многом определяется преобладанием изоформы фермента с разной активностью [2]. Таким образом, личная и, как выяснилось, даже этническая устойчивость к алкоголю, т. е. степень его токсичности, в значительной мере обусловлена совокупным эффектом активности изоферментов АДГ и АлдДГ, т. е. суммарным эффектом первого и второго этапов метаболизма этанола. Количество и длительность действия ацетальдегида во многом определяют и форму алкогольной патологии, и скорость прогрессирования патологического процесса в печени [2]. ЖДП не является застывшей структурой. Прекращение приема алкоголя без воздействия других гепатотоксических факторов приводит к полной морфологической нормализации гепатоцита. При продолжающейся алкоголизации следующим этапом прогрессирования алкогольного повреждения печени является алкогольный гепатит, когда при микроскопическом исследовании печени выявляют некроз гепатоцитов. Особенностью некроза гепатоцитов на фоне ЖДП является формирование мелких гранулем либо из одних макрофагов, либо, что чаще, инфильтрат носит смешанный характер. Этот вариант определяют как «липогранулема». Внутридольковые некрозы и липогранулемы рассматривают как первые признаки стеатогепатита, а нарастание их количества и увеличение размера как усиление активности и ухудшение прогноза [1]. При алкогольном гепатите также наблюдают баллонную дистрофию гепатоцитов. Считается, что баллонная дистрофия вызвана задержкой воды в гепатоците и нарушением функциональной способности микротрубочек, в частности, способности осуществлять экскрецию белков [9, 12, 13]. Всегда внимание при алкогольном гепатите привлекают тельца Мэллори (алкогольный гиалин). Тельца Мэллори при окраске гематоксилином и эозином являют собой пурпурно-красные включения в цитоплазме гепатоцита. Они образованы скоплением органелл, промежуточных филаментов и состоят из цитокератиновых белков. Выявление алкогольного гиалина говорит о разрушении гепатоцита [9, 12, 13]. При алкогольном гепатите в зоне III выявляют склерозирующий гиалиновый некроз — максимальное скопление коллагена, волокна которого расположены перисинусоидально и окружают гепатоциты. Алкогольный гепатит рассматривают как предшественник алкогольного цирроза. Патогенез накопления триглицеридов в печени при жировой дистрофии любой этиологии включает следующие основные звенья [4]:
В генезе каждой этиологической формы ЖДП имеется преобладание отдельных из основных механизмов. Алкоголь в ткани печени как органический растворитель может повреждать мембраны клеток и митохондрий, но ведущим фактором развития алкогольной ЖДП (АЖДП) считают высокую и длительную концентрацию в ткани печени ацетальдегида и ассоциированное с этим высокое содержание НАДН. При этом интенсифицируется периферический липолиз и повышается захват печенью жирных кислот. При воздействии ацетальдегида увеличивается синтез ТГ в митохондриях печени, снижается бета-окисление жирных кислот, а также формирование липопротеинов и их выход из печени. Увеличение в гепатоците количества и размеров жировых включений приводит к фатальному нарушению метаболизма печеночной клетки и ее гибели, т. е. к стеатонекрозу [1, 9, 10]. Стеатонекроз при алкогольной интоксикации (АИ) является одним из пусковых механизмов развития алкогольного стеатогепатита (АСГ). В генезе АСГ участвуют и другие последствия токсических эффектов ацетальдегида. Основным звеном служит запуск при его участии перекисного окисления липидов (ПОЛ). Активация ПОЛ приводит к увеличению потребности в кислороде в печеночной дольке, развитию гипоксии, особенно в центролобулярной зоне, что приводит к дальнейшему некрозу гепатоцитов. Наблюдается также истощение содержания глутатиона. Важным в понимании патогенеза является эффект связывания ацетальдегида с фосфолипидами, что приводит к разрушению клеточной мембраны и мембран митохондрий. Ацетальдегид сенсибилизирует Т-клетки, увеличивая продукцию провоспалительных цитокинов, повреждает микротрубочки цитоскелета и нарушает репаративные процессы в ядре гепатоцита. Жировая и баллонная дистрофия сопровождается увеличением объема гепатоцитов, повышением внутриклеточного давления. Ацетальдегид увеличивает экспрессию гена коллагена, активирует клетки. И это, суммируясь с воспалительными последствиями некроза гепатоцитов, является основой развития фиброза и цирроза печени. Можно предположить, что на фоне истощения антиоксидантной защиты при хронической алкогольной интоксикации (ХАИ) «толчком» к «оксидантному стрессу» может служить алкогольный эксцесс, особенно с употреблением жирной пищи. При исследовании печени лиц, не злоупотреблявших алкоголем, в 1980 г. Ludwig J. и соавт. [15] обнаружили гистологическую картину, идентичную алкогольному гепатиту. Динамика этого этиологического варианта патологии печени, получившего название «неалкогольная жировая болезнь печени» (НАЖБП), аналогична алкогольному: ЖДП (неалкогольный стеатоз) — неалкогольный стеатогепатит (НАСГ) — цирроз печени. Критериями диагноза НАЖБП явлются [16]:
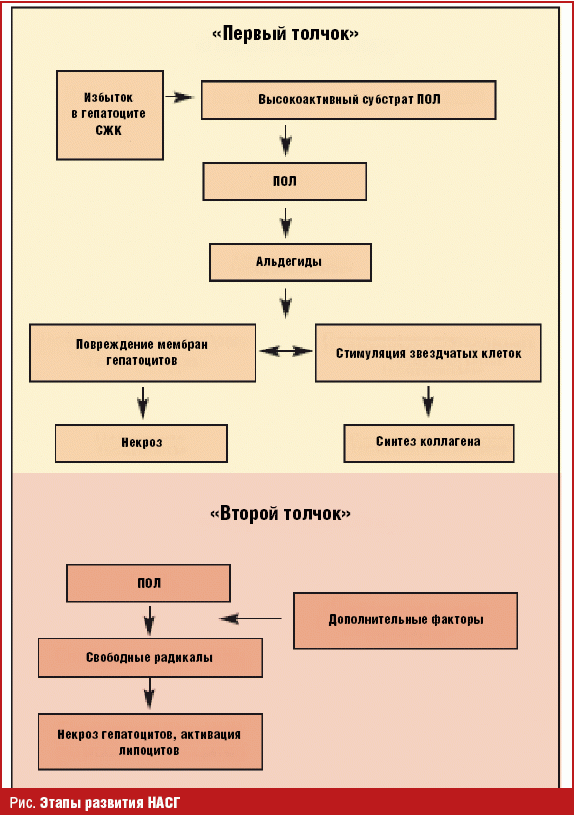
Эпидемиологическое соотношение АБП/НАЖБП составляет 10–15:1. При пункционной биопсии по поводу диффузной патологии печени НАСГ обнаружен в 7–9% [17]. В России в 2007 г. была проведена скрининговая программа по выявлению распространенности НАЖБП и определению факторов риска развития заболевания. В эту программу были включены все пациенты в возрасте 18–80 лет, приходившие на прием к терапевтам поликлиник независимо от причины обращения (с явными признаками заболевания печени или с отсутствием таковых). При обследовании 30 787 пациентов в поликлинике НАЖБП была отмечена у 26,1% пациентов. В этой группе стеатоз определен в 79,9%, НАСГ — у 17,1%, цирроз печени — у 3% [18]. В патогенезе НАЖБП традиционно рассматривают два этапа — два «толчка» (рис.). Первый обусловлен нарушением углеводного и липидного обмена. При этом отмечают высокую роль инсулинорезистентности в генезе НАЖБП и НАСГ. Отмечено, что НАЖБП весьма часто сопровождает метаболический синдром (МС), при котором инсулинорезистентность является ведущим звеном [19, 20]. В соответствии с этапами патогенеза выделяют первичную и вторичную НАЖБП. При первичной НАЖБП, когда этиологическими факторами являются ожирение, сахарный диабет (СД) 2-го типа, дисгиперлипидемии, выявляют высокое содержание ТГ, липопротеинов и СЖК в крови и в печени. Накопление СЖК в печени способствует высокому уровню инсулина в крови, гиперинсулинизм, сопровождающий ожирение, СД 2-го типа и МС, является патогенетическим фактором, поскольку инсулин стимулирует синтез СЖК, ТГ, а также снижает бета-окисление СЖК и эвакуацию липидов из печени. Такой патогенез соответствует первичному варианту НАЖБП. Предполагается, что «первым толчком» при первичном варианте НАСГ является накопление СЖК в гепатоците. СЖК являются высокореактивным субстратом перекисного окисления липидов (ПОЛ). Этот процесс с образованием активных радикалов приводит к повреждению митохондрий и клеточных мембран (рис. 1).
Возникло понимание, что только избыточное накопление в печени СЖК является необходимым, но недостаточным для возникновения «оксидантного стресса». Сформулировалось представление о «втором толчке», приводящем к НАСГ. Индукторами, дополнительными факторами «второго толчка» рассматривают воздействие лекарств, дефицит в пище антиоксидантов, гормональный дисбаланс. Со «вторым толчком» возникло положение о вторичном варианте НАЖБП. Список заболеваний и ситуаций, при котором возникают «вторичные» НАЖБП и НАСГ, весьма широк и включает: синдром нарушенного всасывания, особенно при операциях по поводу ожирения, интенсивное снижение массы тела, длительное, несбалансированное парентеральное питание, болезни накопления [17]. Определены также лекарства, прием которых весьма часто сопровождается развитием НАСГ, это — амиодарон, глюкокортикостероиды, тетрациклин, НПВП, метотрексат, синтетические эстрогены, тамоксифен. Показано, что тетрациклин снижает скорость бета-окисления СЖК. Амиодарон угнетает процесс бета-окисления и способствует образованию активных кислородных радикалов, он также подавляет лизосомальный метаболизм липидов. Эстрогены снижают бета-окисление, влияя на функцию и структуру митохондрий [17]. Таким образом, прослеживается общность звеньев патогенеза АБП и НАЖБП, это прежде всего активация ПОЛ, окислительный стресс, поражение фосфолипидов мембран митохондрий, нарушение системного и клеточного звеньев липидного обмена, нарушение системного и клеточного звеньев липидного обмена. Также можно предположить «перекрест» предрасполагающих факторов ожирения, инсулинорезистентности, гиперлипидемии, нарушения кишечного пищеварения. Патология пищеварения, приводящая к НАСГ, сопровождается снижением поступления в печень метионина, холина, участвующих в метаболизме липидов, а также снижением уровня антиоксидантов. В клинической картине АЖБП значительную роль играют системные, полиорганные последствия ХАИ. Причем органные последствия ХАИ, такие как хронический панкреатит с внешнесекреторной недостаточностью, хронический атрофический гастрит, приводят к мальабсорбции, что при вторичной НАЖБП является этиологическим фактором. Алкогольный энтерит, избыточный бактериальный рост в тонкой кишке могут быть причиной эндотоксемии. Как общий фактор можно рассматривать и нарушение пищевого поведения. Известно, что у трети больных АЖБП отмечают повышенный индекс массы тела (ИМТ) [21]. Это объяснимо добавочными алкогольными калориями (1,0 г этанола — 7 ккал), стимулированием кислотопродукции алкоголем, приводящим к повышению аппетита, острые закуски, неконтролируемое потребление пищи с избытком животных жиров. При «голодном» пьянстве возникает дефицит белков, ненасыщенных жирных кислот, антиоксидантов, витаминов. Можно отметить еще несколько схожих позиций при анализе звеньев патогенеза АЖБП и НАЖБП. При ХАИ отмечено нарушение липидного обмена, проявляющееся в повышении в крови содержания ТГ и холестерина. Прослежена связь «пикового» повышения с алкогольным эксцессом и алкогольным абстинентным синдромом (ААС) [21]. Исследование уровня инсулина в крови при алкоголизме продемонстрировало его повышение, степень повышения четко была ассоциирована с характером поражения: так, если в контрольной группе уровень иммунореактивного инсулина натощак был 13,8 ± 1,2, то при ЖДП — 24,85 ± 3 (р ≤ 0,05), а при алкогольном гепатите 44,8 ± 9,7 (р ≤ 0,05). Выявлено, что при алкогольной болезни у лиц с повышенной массой тела ИМТ был существенно повышен. Исследование С-пептида подтвердило наличие гиперинсулинизма при АЖБП и АСГ [22]. Одно из перспективных направлений представляет изучение характера питания, ожирения и инсулинорезистентности как факторов, предрасполагающих к проявлению токсических свойств этанола. Избыточное общее развитие жировой ткани может способствовать развитию и прогрессированию АБП вследствие высокого уровня продукции в ней свободных радикалов, фактора некроза опухоли альфа (ФНО-альфа) и профиброгенных веществ (ангиотензина II, катехоламинов, нейропептида Y и лептина). Одним из критериев диагноза НАСГ является: отсутствие употребления алкоголя в гепатотоксичных дозах, т. е. идентификация НАСГ основана на определении негепатотоксичной дозы [15, 16, 23]. Идеальным было бы включить в критерии НАСГ позицию «исключение употребления алкоголя». Но это невозможно. Следует учитывать при уточнении количества употребленного алкоголя, что больные склонны уменьшать в диалоге с врачом дозу выпитого. В анамнезе следует выявить, что доза употребленного оказывается больше планируемой, что имеется постоянное желание выпить, прослеживается безуспешность осуществления отказа от приема алкоголя даже в неподходящих ситуациях. Особого внимания заслуживают дефекты социальной и профессиональной деятельности, изменение толерантности, похмельный синдром. При дифференциальном диагнозе с НАЖБП следует обратить внимание на: расширение сосудов носа, инъецированность склер, эритему ладоней, а также увеличение околоушных желез, геникомастию, контрактуру Дюпюитрена. Объективными маркерами ХАИ служат результаты лабораторных исследований:
Основной результат, позволяющий при физическом исследовании объективизировать предположение о патологии печени, — обнаружение гепатомегалии и значительно реже спленомегалии. На практике гепатомегалию обычно выявляют в следующих ситуациях: выявлении «факторов риска» АЖБП и НАЖБП, при жалобах и анамнезе, позволяющих предположить патологию печени, при «патологических» биохимических исследованиях, нередко гепатомегалию выявляют случайно — при УЗИ. При НАЖБП и АЖБП пациенты чаще предъявляют жалобы, обусловленные сопутствующей патологией, т. к. сами НАЖБП и АЖБП не имеют специфических клинических признаков. Следует отметить, что в группах больных НАСГ и АСГ имеется различие в излагаемых жалобах и клинических данных. Пациенты с АСГ реже испытывают боли в правом подреберье (или меньше жалуются на них). Известно, что больные с алкоголь-ассоциированной патологией отличаются такой особенностью: боли у них менее выражены, это эффект обезболивающего, антидепрессивного, эйфорирующего действия алкоголя и следствие вызванной алкоголем висцеральной полинейропатии. Астенические жалобы встречаются чаще у лиц с АСГ. При АЖБП могут быть жалобы, входящие в «синдром выходного дня», когда в понедельник (после употребления алкоголя в пятницу и субботу) имеет место астенический синдром и синдромы желудочной и кишечной диспепсии. При НАЖДП пациенты предъявляют жалобы, обусловленные чаще всего дискинезией желчного пузыря, и жалобы, характерные для функциональной желудочной диспепсии по варианту либо синдрома эпигастральной боли, либо постпрандиального дистресс-синдрома. При АСГ чаще наблюдают симптомы кишечной диспепсии. При НАСГ чаще отмечали признаки «вовлечения» желчного пузыря. Лабораторные показатели цитолиза при НАСГ отражают выраженность активности гепатита. «Точку» в диагнозе ставит пункционная биопсия печени. Она позволяет определить этиологию, степень активности, выраженность фиброза, верифицировать цирроз, оценить эффективность лечения. Следует иметь в виду, что биопсия печени — инвазивное вмешательство с возможным развитием осложнений от незначительных (около 30% пациентов испытывают боль) до более тяжелых (включая смертность примерно в 0,03% случаев). Кроме того, боль в месте прокола и побочные эффекты анестезии заставляют до 1/3 больных избегать биопсии, что приводит к замедлению принятия решения о начале противовирусной терапии и о продлении сроков госпитализации [40]. В связи с этим повышается значение неинвазивных методов оценки структурного состояния печени. Обязательным является ультразвуковое исследование (УЗИ). В настоящее время УЗИ помимо размеров, структуры, характера паренхимы, с применением специальной аппаратуры позволяет определить степень жировой инфильтрации и фиброза. Выделяют четыре основных ультразвуковых признака стеатоза печени [16]:
В практику входят методы неинвазивной оценки степени фиброза — эластография, диагностические шкалы. Лабораторные показатели цитолиза при АСГ зависят от времени, прошедшего с момента употребления алкоголя, но четко уровень ГГТ при АСГ заметно выше, чем при НАСГ. Это объясняет гистологические проявления каналикулярного холестаза в центролобулярной зоне. Течение и прогноз и НАСГ, и АСГ во многом определяет наличие общих факторов прогрессирования, таких как: высокая степень ожирения, гипертриглицеридемия, инсулинорезистентность, высокая активность печеночных ферментов крови, пожилой возраст, неполноценность питания. Сочетание этиологических факторов АБП и НАЖБП определено как коморбидность [24]. Запрет приема алкогогля считается обязательным при лечении НАЖБП. Отмечено, что за 10 лет прогрессирование НАСГ с развитием фиброза и цирроза печени происходит у 10% больных [24]. Прогрессирование АСГ зависит от длительности ХАИ, количества употребляемого алкоголя, типа употребления, характера питания. Прогноз при АСГ значительно хуже, так, при НАСГ 10-летняя выживаемость 59%, а при АСГ — 15% [10]. Общие звенья патогенеза позволяют обсуждать и общие позиции в подходах к лечению АБП и НАЖБП. Поскольку ожирение и инсулинорезистентность — главные факторы развития НАЖДП и НАСГ, основной задачей немедикаментозной терапии является уменьшение калорий в диете за счет главным образом жиров и углеводов, увеличение физической нагрузки. Снижение массы тела идивидуализированно. Общие принципы — снижение массы тела медленное (1,5–2 кг в месяц), резко ограничивают прием простых углеводов, насыщенных жиров. Диета должна включать достаточное количество пищевых растительных волокон (30–40 г/сут), целесообразно использовать пшеничные отруби, семя льна. Известно, что соблюдают рекомендации отказа от алкоголя не более 1/3 пациентов. Лечение алкогольной болезни печени включает следующее: отказ от алкоголя, увеличение белка в диете (1,0–1,5 г/кг), увеличение ненасыщенных жирных кислот, применение эссенциальных фосфолипидов, применение средств растительного происхождения, содержащих флавоноиды, препаратов урсодезоксихолевой кислоты, адеметионин, колхицин. Отказ от приема алкоголя — важный фактор лечения. Считается, что 1/3 снижает дозу спиртного, а 1/3 продолжает употреблять в привычном объеме. Прекращают пить, как правило, лица с невысокой толерантностью, с отсутствием или слабым синдромом похмелья, мнительные (кодирование!) и лица с высоким социальным статусом. Применение эссенциальных фосфолипидов на фоне снижения дозы алкоголя, но при продолжении приема в среднем 40 г этанола ежедневно уменьшило темп образования фиброза у пациентов по сравнению с получавшими плацебо [25]. При АСГ и НАСГ существуют общие факторы, влияющие на стеатоз печени. Это прежде всего несбалансированный рацион питания. Около трети лиц, злоупотребляющих алкоголем, имеют избыток массы тела, что в первую очередь обусловлено повышением аппетита при стимуляции кислотопродукции алкоголем, снижением контроля за рационом и высокоэнергетической ценности алкоголя (1 г этанола = 7 ккал). Другая категория, входящая в группу «голодного пьянства», имеет дефицит массы тела и рацион без белка и витаминов. Для достижения снижения веса применяют ингибиторы панкреатической и желудочной липазы, средства, повышающие чувство насыщения, увеличивающие чувствительность к инсулину. С большой осторожностью следует относиться к назначению препаратов, направленных на устранение гипертриглицеридемии и дислипидемии. Важным является использование препаратов с гепатопротективным и антиоксидантным эффектом. В терапии НАЖБП используют эссенциальные фосфолипиды, альфа-липоевую кислоту, адеметионин, флавоноиды, урсодезоксихолиевую кислоту, витамин Е, витамин С. Важнейшим патогенетически обоснованным, хорошо себя зарекомендовавшим средством, направленным на терапию основных повреждающих звеньев, являются эссенциальные фосфолипиды. Эссенциальные фосфолипиды это фосфатидилхолин, в состав которого входят полиненасыщенные жирные кислоты, главным образом линолевая (около 70%), а также линоленовая и олеиновая. Фосфатидилхолин, содержащий столь большое количество полиненасыщенных жирных кислот, также обозначают термином «полиенилфосфатидилхолин» (polyenylphosphatidilcholine, РРС). Здоровый человек получает полиненасыщенные жирные кислоты с пищей, главным образом из растительных масел. В промышленных целях для создания лекарственных препаратов РРС экстрагируют из соевых бобов. В составе РРС имеет главное значение и составляет 50% 1,2-дилинолеоилфосфатидилхолин (DLPC). Именно это вещество обладает наиболее высокой биодоступностью и выступает как активный ингредиент лекарственных препаратов эссенциальных фосфолипидов [26]. Механизм их действия многогранен и складывается из нескольких основных компонентов, таких как [27]:
Также в механизме лечебного эффекта эссенциальных фосфолипидов рассматривают [31]:
Эссенциале® форте Н убедительно занимает ведущую позицию в группе гепатопротекторов. Препарат широко и успешно применяют во многих странах мира более 50 лет [28]. Эффективность и безопасность Эссенциале® форте Н продемонстрированы в большом количестве клинических исследованиях, в том числе, что важно, в двойных слепых. Производители генерических препаратов до настоящего времени аналогичных исследований не проводили [26]. Препарат Эссенциале® форте Н является наиболее изученным среди препаратов, содержащих эссенциальные фосфолипиды. Широкий патогенетический спектр лечебного действия, достоверные положительные результаты клинического применения позволили препарату Эссенциале® форте Н в течение более 30 лет являться в России ведущим гепатопротектором. Позитивное влияние на метаболизм клеточных мембран и митохондрий, антиоксидантный эффект, нормализующее влияние на липидный обмен явилось залогом успешного применения Эссенциале® форте Н при АЖБП и НАЖБП, учитывая «перекрест» патогенеза [29–32]. Более того, доказано, что содержание фосфатидилходина у пациентов с НАЖБП достоверно снижено по сравнению со здоровыми [43]. В работах, посвященных применению Эссенциале® форте Н при жировой дистрофии печени алкогольного и неалкогольного генеза, продемонстрировано уменьшение гепатомегалии и улучшение эхографической картины печени [33, 34]. Рандомизированное двойное слепое, плацебо-контролируемое исследование пациентов с гистологически доказанной жировой болезнью печени было проведено с участием 30 пациентов, разделенных на две группы по 15 человек. Первая группа получала Эссенциале® форте Н, вторая — плацебо. Длительность терапии составляла 6 месяцев. По результатам исследования было установлено значительное уменьшение размеров печени у пациентов, принимавших Эссенциале® форте Н, в отличие от группы пациентов, принимавших плацебо [44]. Терапия Эссенциале® форте Н при АСГ и НАСГ привела к достоверному снижению активности АЛТ, АСТ, ГГТ, билирубина и, что очень важно, к улучшению гистологической картины, включая уменьшение элементов воспаления и отсутствие прогрессирования фиброза при сравнении с контролем [35, 36]. Эффективность препарата Эссенциале® форте Н при алкогольных поражениях печени была доказана в ряде исследований. В двойном слепом плацебо-контролируемом исследовании больных острым алкогольным гепатитом 53 пациента принимали Эссенциале® форте Н по 12 капсул/сут, 51 пациент получал плацебо в течение 2 лет. В ходе исследования была отмечена заметная тенденция к увеличению выживаемости в исследуемой группе по сравнению с плацебо (69% и 49% соответственно, р = 0,11) [42]. В другом двойном слепом плацебо-контролируемом исследовании приняли участием 40 пациентов с алкогольным жировым гепатозом: 20 больных принимали Эссенциале® форте Н по 2 капсулы 3 раза/сут в течение 12 нед, 20 больных — принимали плацебо. В результате терапии у больных 1-й группы, получавших Эссенциале® форте Н, отмечалось значимое снижение активности АЛТ, АСТ, ГГT и щелочной фосфатазы, билирубина [45]. Гепатопротекторное действие Эссенциале® форте Н явилось основанием эффективного применения препарата при лекарственных поражениях печени [37]. Успешный результат отмечен при сочетании НАЖБП с метаболическим синдромом, при котором риск сердечно-сосудистых осложнений весьма высок, особенно у женщин в период менопаузы [38, 39]. Продолжительность применения препарата Эссенциале® форте Н (капсулы) не ограничена инструкцией [41]. Рекомендуемый нами курс Эссенциале® форте Н состоит из введения 5–10 мл (1–2 ампулы) внутривенно в течение 10–15 дней и одновременно перорального приема по 2 капсулы 3 раза в сутки во время еды, далее следует принимать по 2 капсулы 3 раза/сут в течение 2–3 месяцев. Целесообразно проведение 2–3 курсов в год. Клинически значимых результатов можно добиться при длительном применении. Прием препарата может продолжаться 6–12 месяцев и более. Препарат хорошо переносится. Таким образом, алкогольная болезнь печени и неалкогольная жировая болезнь печени — это заболевания, в патогенезе которых много общего. В этом кроется объяснение тому факту, что неотъемлемым звеном терапии патологии печени токсического и метаболического генеза являются Эссенциальные фосфолипиды, среди которых Эссенциале® форте Н является патогенетически обоснованным, высокоэффективным оригинальным средством. Эссенциале® форте Н — это препарат, который доказал свою эффективность при различных поражениях печени как во многих клинических исследованиях, так и повседневной практике. Во многом, отвечая современным требованиям к гепатопротекторам, Эссенциале® форте Н выгодно отличается от подавляющего числа других гепатопротекторов, представленных на российском рынке, благодаря чему его можно рекомендовать как гепатопротектор выбора в терапии алкогольной и неалкогольной жировой болезни печени. В. М. Махов, доктор медицинских наук, профессор Литература
Статья опубликована в журнале «Лечащий Врач» |